利用细胞成像系统进行细胞线粒体毒性的检测
评价待选新药对细胞线粒体产生的毒性作用一直被认为是药物筛选过程中的关键步骤,目前可轻松通过不同颜色的荧光染料来标记细胞线粒体后来检测其活性的变化,整个检测过程中通常也需要结合细胞核复染色法,例如使用DAPI染料,这样就可以在图像中轻松识别出所有细胞。可以利用成像系统的一个荧光通道识别被染核的细胞,而细胞线粒体活性检测可以通过特定的线粒体染料标记后,来分析第二个荧光通道中每个标记后细胞的荧光信号强度值。然而,细胞核复染色过程会增加一系列额外的操作步骤,使得实验过程变得繁琐、拖延检测时间。来自于Molecular Devices公司的StainFree™技术(无标记分析技术)可以解放研究人员,使其无需借助于繁琐的细胞核复染色法来识别细胞,可以直接利用SpectraMax® MiniMax™ 300 细胞成像系统的透射光通道来直接识别出单个细胞。
此篇应用文献重点介绍如何利用SpectraMax® i3多功能酶标仪的细胞成像功能来检测细胞线粒体毒性,缬氨霉素,一种离子型抗生素,可对PC12细胞线粒体功能造成损伤,使用MitoTracker Deep RedFM来标记线粒体后对整个过程进行检测,然后分别使用StainFree方法和细胞核荧光染料标记法对细胞计数,SoftMax Pro软件分析比较两组结果。SpectraMax MiniMax 300细胞成像系统和SoftMax Pro软件组合后,可以帮助研究人员获取图像信息和进行数据分析,准确、快速的给出潜在化合物对细胞线粒体毒性的浓度效应学曲线。
1、基于细胞检测试验方法的设置
使用含有2.5%胎牛血清、15%的马血清和1%青霉素/链霉素的F-12K培养基来培养PC12(大鼠肾上腺嗜铬瘤细胞)细胞,在黑色底通的96孔板中每孔加入100ul配好的培养基,细胞的密度为10,000/孔,培养过夜。
隔天,细胞孔内加入缬氨霉素,其浓度范围是1μM至1nM并按12浓度梯度关系进行稀释,然后将处理后的微孔板放入37度二氧化碳培养箱中培养24小时。完成孵育处理后,将混有化合物的培养基去除, 随后加入含有100nM 的MitoTracker Deep Red FM(MTDR)染料的新鲜培养基。此试剂可以标记活细胞中的线粒体,可以利用MinMax 细胞成像系统的远红外荧光通道检测其在远红外波段下的荧光强度值。
细胞孵育30分钟后,去除混有染料的培养基,使用4%多聚甲醛固定细胞,固定后的细胞核使用EarlyTox Dead Green 染料来标记(Molecular Devices cat. #R8216)。虽然固定后是无需使用StainFree方法来分析细胞数目、形态的,但是此目的是比较这次实验中所有细胞在不同通道下获得数据的一致性。利用MinMax 细胞成像系统的透射光通道对细胞进行成像,获取细胞数目和分析其形态变化,利用其红色荧光通道检测其线粒体活性。同样利用系统的绿色荧光通道对染核细胞进行计数分析后与使用透射光通道下StainFree方法计数的细胞进行比较。
使用SoftMax Pro软件,设置两种不同的成像分析方法,第一种分析,单个细胞的识别是通过StainFree方法,可在透射光通道下识别单个细胞而无需利用细胞核荧光染料分子进行标记。为识别每个细胞,在软件中将测量的线粒体的红色荧光信号以一定形式参数输出。
第二种使用核染料标记分析法,为了验证StainFree方法获得结果的准确性。这里,绿色核染料标记细胞可利用成像系统的绿色荧光通道进行检测。因为,细胞核染色覆盖区域并不与线粒体荧光染料染色所覆盖的细胞质区域重叠,核复染色覆盖的区域可占4个像素点,约为7.5μm。这样我们可以通过软件分析出细胞质中线粒体经过红色荧光染料标记后的结果。
对于每种例子进行分析,其线粒体经过化合物处理后我们就可绘出每个细胞线粒体平均荧光信号强度值与化合物浓度值的对应关系图,软件可以自动计算出IC50的值。
2、结果
当使用缬氨霉素处理被标记过线粒体的PC12细胞,发现其会呈现出浓度依赖性关系,信号值会随着浓度升高而降低。无论我们是使用核染料标记或者StainFree方法都可以识别出单个细胞,这样我们可以定量出基于每个细胞线粒体的荧光信号值,评估出处理化合物与线粒体浓度效应关系,如图1,无标记分析技术用于识别所有细胞,紫色伪彩覆盖区域用于代表单个细胞。
图1:StainFree技术检测PC12细胞
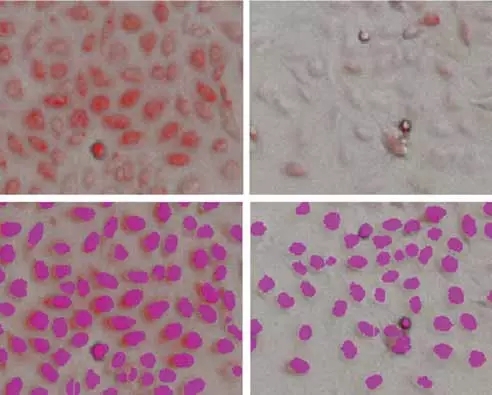
上边一行,透射光与红色荧光染料(线粒体)标记成像重叠结果,下边一行,无标记分析技术检测单个细胞(紫色区域),左侧,未处理细胞;右侧,使用1μM缬氨霉素处理后的细胞。
图2显示为使用绿色荧光染料标记细胞核后识别单个细胞的结果,这里,紫色伪彩覆盖区域为细胞核。伪彩覆盖外延的四个像素点区域可以捕获更多信号,这样可用于分析每个细胞线粒体的荧光信号强度。伪彩周围颜色较浅边界为延伸区域,区域大小可由用户自定义。
图2:荧光标记方法检测PC12细胞

左侧,绿色荧光(细胞核)成像和红色荧光(线粒体)成像重叠结果示意图,右侧,使用荧光信号标记出单个细胞的细胞核,深紫色伪彩覆盖区域(绿色箭头),浅紫色边界为捕获目标细胞延伸区域来进行的分析结果(黄色箭头)。
使用两种分析方法获得IC50值结果(图3)来看,无标记分析方法完全可以替代费时、费力以及高成本的核染料标记细胞计数法。
图3:PC12细胞经缬氨霉素处理后的IC50曲线

针对细胞的浓度效应学曲线的分析分别使用了StainFree技术(蓝色)和细胞核荧光染料标记法(绿色),针对每个细胞线粒体平均荧光信号强度值和缬氨霉素浓度值做曲线作图,两种方法获得几乎一致的曲线结果,而且其IC50值均为57nM。
结论
当使用一种细胞荧光标记物时,例如线粒体染料,需要基于每一个细胞进行定量,所以首先要识别出每一个细胞,然后就可以量化每一个细胞的荧光标记物的信号强度。目前有很多种方法可以识别出单个细胞,一种较为流行的方法是先固定细胞后,使用细胞核染料进行标记。此外一种更加快速、节省成本、对细胞没有毒性作用的无标记分析技术(StainFree)的最大优势是无需固定细胞和标记染料分子。
这篇应用中我们介绍了StainFree技术和SpectraMax MinMax300细胞成像系统结合后,第一步可利用StainFree技术快速识别出单个细胞,然后利用荧光通道进一步检测出化合物处理后的被标记线粒体荧光信号强度变化,而且获得结果做出的浓度效应曲线与细胞核染料标记法获得的效应曲线几乎是相一致的,StainFree技术无需对细胞预先固定,无需像DAPI一样的细胞核染料,更快的检测速度和更加灵敏的检测结果使得整个检测流程更加便捷,此外因为此方法不会影响细胞活性,这些细胞还可以用于其它进一步的检测实验。
更多详情请关注Molecular Devices美谷分子仪器官网

